 Integrované laboratoře biomedicínských technologií, slavnostně otevřené loni v listopadu, v sobě koncentrují výzkum MU, jehož výsledky by mohly být uplatněny v medicíně. Své místo zde proto našli i vědeckovýzkumní pracovníci Ústavu experimentální biologie, který vznikl v lednu letošního roku reorganizací biologické sekce Přírodovědecké fakulty MU. Právě vědci z tohoto ústavu řeší druhý největší výzkumný záměr MU. Záměr Molekulární podstata buněčných a tkáňových regulací získal od MŠMT na sedm let přes 300 milionů korun.
Integrované laboratoře biomedicínských technologií, slavnostně otevřené loni v listopadu, v sobě koncentrují výzkum MU, jehož výsledky by mohly být uplatněny v medicíně. Své místo zde proto našli i vědeckovýzkumní pracovníci Ústavu experimentální biologie, který vznikl v lednu letošního roku reorganizací biologické sekce Přírodovědecké fakulty MU. Právě vědci z tohoto ústavu řeší druhý největší výzkumný záměr MU. Záměr Molekulární podstata buněčných a tkáňových regulací získal od MŠMT na sedm let přes 300 milionů korun.
Celý záměr je rozdělen do čtyř částí, z nichž každá má svou oblast zájmu a svého garanta. Společně pak využívají především přístrojové vybavení a služby Laboratoře speciálních technik na Oddělení funkční genomiky a proteomiky, která je nejen jakousi servisní organizací výzkumu, ale především centrem vývoje a aplikací špičkových technologií v oblasti genomiky a proteomiky. „Měli jsme obavu, jak toto rozdělení bude fungovat, ale náš záměr se docela dobře naplňuje, metodiky jednotlivých částí se začínají propojovat, lidé spolu začínají více komunikovat a vzájemně spolupracovat,“ uvedl po roce výzkumu doc. RNDr. Jiří Fajkus, CSc., odpovědný řešitel.

Vedoucí Laboratoře funkční genomiky a proteomiky Přírodovědecké fakulty MU doc. RNDr. Jiří Fajkus, CSc. Foto: Martina Šmídtová.
První část výzkumu má na starosti prof. RNDr. Jan Šmarda, CSc. Jeho skupina se zabývá regulačními mechanismy živočišných buněk. Pracuje jednak s modelovými liniemi ptačích hematopoietických (krvetvorných) buněk, jednak s buňkami lidskými. Jak známo, nositelkou genetické informace živočichů je DNA sbalená v chromozómech v jádře každé buňky. Konečnými produkty, které jsou kódovány jednotlivými sekvencemi DNA (geny), jsou proteiny, které jsou podstatou všech živých organismů. Od sekvence DNA k výslednému proteinu je však dlouhá cesta, které se říká genová exprese a při níž se uplatňuje hned několik úrovní regulačních mechanismů. Regulaci podléhá nejen to, jaký gen nebo soubor genů je právě aktivní, ale i koncové úpravy výsledných proteinových produktů, jejich transport a odbourávání. Prostřednictvím studia těchto regulačních procesů mohou vědci objasnit mimo jiné i molekulární podstatu přeměny zdravé buňky na nádorovou. Těchto poznatků se snaží využít při hledání způsobů jak buňce nádorové vrátit vlastnosti buňky zdravé. Navíc se část této skupiny zabývá aplikovaným výzkumem. Jeho cílem je využítí změn ve struktuře chromozomů, které vznik rakoviny doprovázejí, pro zpřesnění diagnostiky tohoto onemocnění u člověka.
Nesmrtelnost, která zabijí
S výzkumem rakoviny úzce souvisí i druhá oblast, jejímž garantem je doc. Jiří Fajkus. Jeho skupina zkoumá hlavně telomery a telomerázy. Telomera je specifická chromatinová struktura na konci chromozómu, která odlišuje přirozené konce chromozomů od neopravených chromozomálních zlomů a chrání chromozomy před vzájemným spojováním. Při každém kopírování DNA, které předchází buněčnému dělení, se telomera mírně zkracuje, protože kopírování konců není úplné. Pokud se zkrátí natolik, že telomery již nemohou vykonávat svou funkci, buňka se přestává dělit a posléze odumře. Zkracování telomer je blokováno u zárodečných a kmenových buněk díky působení telomerázy, enzymu, který dokáže DNA znovu prodloužit a tak kompenzovat její zkracování v důsledku neúplné replikace. Jak se však kmenové buňky diferencují do specializovaných tkáňových typů, aktivita telomerázy klesá. U diferenciovaných lidských somatických buněk je pak aktivita telomerázy velmi nízká nebo nulová, což je příčinou přirozené smrtelnosti buněk. Výjimkou jsou jen rakovinné buňky, u kterých se telomeráza znovu aktivuje. K tomuto jevu dochází u 85 % nádorů různých typů.
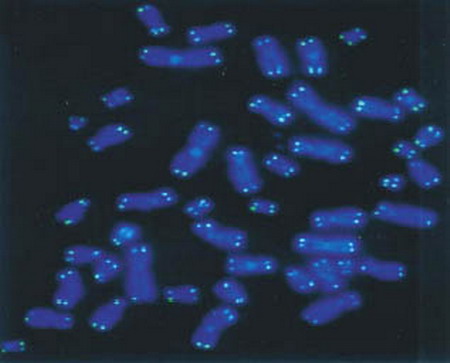
Telomery lidských chromozomů analyzované pomocí techniky PRINS. Telomery jsou patrné jako svítící tečky na modře obarvených chromozómech (pomocí barviva DAPI).
Právě kvůli vztahu telomerázy k buněčnému stárnutí a rakovině se tento enzym stal středem pozornosti vědců i farmaceutických firem. Pokud by byl nalezen způsob, jak činnost telomerázy v rakovinných buňkách zastavit (inhibovat tento enzym), dalo by se to využít v léčbě rakoviny. „Rakovinnou buňku tím sice nezabijete, ale vrátíte jí smrtelnost, zbavíte ji možnosti neomezeného růstu. Nádor tedy přímo neodstraníte, nicméně zabráníte, po jeho např. chirurgickém odstranění, vzniku metastáz,“ vysvětluje Jiří Fajkus. Již dnes se měření aktivity telomerázy používá při diagnostice nádorů a zároveň probíhají klinické zkoušky několika metod „protitelomerázové“ léčby nádorů.
Při studiu telomer a telomerázy se přitom uplatňují jako vhodný experimentální model především rostliny. Má to několik důvodů. Prvním je přirozená nesmrtelnost rostlinných buněk, která souvisí s tím, že telomeráza v rostlinných buňkách na rozdíl od lidských může být opakovaně zapínána a vypínána podle úrovně dělení buněk, které je zase regulováno hladinami rostlinných hormonů (viz níže). „Dalším důvodem je naše nedávné zjištění, že u velké skupiny jednoděložných rostlin byly během evoluce nahrazeny typické rostlinné telomery telomerami lidského typu, regulační faktory, které se na nich uplatňují, by mohly být účinné i pro regulaci syntézy telomer v lidských buňkách. Není snad třeba připomínat, za kolik současných farmak, třeba právě z oblasti cytostatik, vděčíme rostlinám a jejich pestrému spektru sekundárních metabolitů,“ dodává Jiří Fajkus.
Výzkum cytokininů
Třetí pracovní skupina, kterou řídí RNDr. Jan Hejátko, Ph.D., se pak soustředí na studium významu hormonů ve vývoji rostlin, a to zejména hormonů cytokininů. Právě cytokininy společně s auxiny jsou zodpovědné za mimořádnou schopnost rediferenciace a regenerace rostlin. Díky nim lze z kterékoliv části, podzemní i nadzemní, vypěstovat celou rostlinu. „Účinky cytokininu na úrovni morfologie rostlin jsou známy již dlouho, dlouho však nebyla známa molekulární podstata jeho působení. V posledních desetiletích se vědci snaží identifikovat celou jeho signální dráhu a k tomu my bychom chtěli také přispět,“ vysvětluje Jan Hejátko. Molekulární biologové se pod jeho vedením zaměřují na studium mechanismu přenosu cytokininového signálu, studiem mezi strukturou a funkcí jednotlivých signálních přenašečů, mechanismu účinku cytokininů nebo jejich interakcí s ostatními hormony. Kromě toho, že tyto procesy u rostlin slouží jako komparativní model pro obdobné procesy u živočichů, mohou mít poznatky z tohoto výzkumu využity i v zemědělství či v rostlinných biotechnologiích. Cytokinin například hraje významnou úlohu ve vývoji endospermu, vnitřního živného pletiva u semene rostlin, tedy i u obilí, jehož zrno je pro výživu člověka nepostradatelné.

Mgr. Ctirad Hofr, Ph.D., odborný pracovník Ústavu experimentální biologie, na snímku pipetuje vzorek získaný z buněk lidské tkáně, který bude přefiltrován a nastříknut na iontoměničovou kolonu perfúzního kapalinového chromatografu, kde dojde k oddělení složek, které vykazují telomerázovou aktivitu od složek extraktu, které jsou neaktivní. Po zakoncentrování purifikovaného extraktu je aktivita detekována za použití vysoce citlivé metody TRAP, která využívá polymerázové řetězové reakce.
Bakterie škodí i prospívají
Skupina prof. RNDr. Jiřího Doškaře, CSc. složená ze čtyř pracovních týmů se zabývá funkční analýzou genomu několika významných skupin bakterií. Centrem zájmu jsou především patogenní bakterie rodu Borrelia způsobující např. lymeskou borreliózu, dále druhy rodu Staphylococcus, které jsou původci mnoha onemocnění sliznice, kůže a orgánů a způsobují též otravy z potravin, a konečně zástupci rodu Treponema, mezi něž patří i původce syfilis. Hlavním cílem studia patogenních bakterií je vyhledání genů zodpovědných za jejich patogenitu, virulenci (schopnost mikroorganismů infikovat) a rezistenci k antibiotikům, dále vypracování nových metod pro spolehlivou molekulární diagnostiku jednotlivých druhů, zpřesnění etiologie onemocnění a zavedení epidemiologických opatření proti šíření závažných infekcí. Jedním z významných cílů je též vývoj nových léčebných přípravků a účinných vakcín.
Další studovanou skupinou jsou bakterie rodů Lactobacillus a Bifidobacterium, které se tradičně využívají při výrobě mléčných výrobků a v poslední době též velmi populárních probiotických preparátů. Na rozdíl od těch výše jmenovaných mají tyto bakterie řadu pro zdraví prospěšných vlastností, např. potlačují vznik rakoviny tlustého střeva a pozitivně ovlivňují imunitní systém člověka. Charakterizace těchto mikroorganismů po genetické stránce a identifikace jejich nových druhů rozšíří jejich využití v potravinářství i farmacii.



